FDA Perspective on the Regulation of AI in Health Care and Biomedicine
FDA Perspective on the Regulation of AI in Health Care and Biomedicine
Title
- FDA Perspective on the Regulation of AI in Health Care and Biomedicine
Information
- Link
- Citation
- Warraich HJ, Tazbaz T, Califf RM. FDA Perspective on the Regulation of Artificial Intelligence in Health Care and Biomedicine. JAMA. Published online October 15, 2024. doi:10.1001/jama.2024.21451
- Topic
- US FDA
- Medical AI
- Regulation
Abstract
- Importance
- 의료 AI 제품에 대한 미국 FDA의 심사 이력과 의료제품 개발, 임상 연구, 임상 환경에서의 활용 가능성, 규제기관의 고려사항 등에 대해 리뷰함
- Observations
- 미국 FDA는 거의 1000개 정도의 AI 활용 의료기기(AI enabled medical device)의 승인(authorized)을 내줌
- 후보 물질 발견과 신약 개발에 활용되는 용도로 AI를 활용한 제품의 신청(submissions)은 몇백건임
- 규제 당국은 의료와 보건 분야에 AI가 활용되는 변화를 이해하고 유연하게 대응해야 하며 기업(Sponsor)도 제품 개발 단계에서의 투명성(transparent)을 담보해야 함
- Life cycle management approach 가 시판후 관리(postmarket performance monitoring)에서 핵심임
- LLM(large language models)에 대해선 특별한 관리가 필요함
- FDA는 환자의 건강 결과(patient health outcome)에 초점을 두어 AI 활용을 통해 제품 개발자(developer), 구매자(payer), 보건 시스템(health system) 사이에 경제적 이익 극대화(financial optimization)를 서로 추구하려는 것에 대한 균형을 맞추어(balance) 주어야 함
The FDA’s History of Regulating AI-Enabled Medical Products
- AI Applications
- 스펙트럼이 다양
- 단순한 알고리즘 적용에서 생성형 AI(generative AI tools) 활용까지 범위가 넓음
- risk-based regulatory scheme에 기반한 유연한 대응이 필요
- 스펙트럼이 다양
- FDA 허가 History
- PAPNET
- 1995년 허가 받은 최초 (partially) AI-enabled emdical device
- 경부암 오진단을 막기 위해 신경망(neural networks)을 활용한 소프트웨어
- 그 후 약 1000 개의 AI-enabled medical device가 FDA 승인을 받음
- 대부분 radiology 분야에 적용, 그 다음은 cardiology
- AI를 신약 개발에 활용
- 수백건 정도(hundreds of regulatory submissions) 신청이 됨
- AI를 약물 discovery 및 development에 활용함
- 2021년 132건의 application은 2020년에 비해 10배 정도 증가
- AI in drug development 적용분야
- 약물 개발 및 적응증 재 설정(enhancing drug discovery and repurposing)
- 임상 시험 디자인 요소 결정(clinical trial design element)
- 용량 최적화(dose optimization)
- 약물 용법 준수(adherence to drug regimens)
- 평가변수 및 바이오마커 평가(endpoint and biomarker assessment)
- 시판후 감시(postmarket surveillance)
- Oncology 분야에 가장 널리 활용, 다음은 정신과(mental health) 분야
- FDA의 역할
- 규제하는 산업 분야에서 AI의 안전하고 효과적인 사용이 되도록 감시
- 규제 원칙을 업계가 준수(compliance)하도록 하는 동시에 혁신에 도움(fostering innovation)을 주어야 함
- 2021년 1월에 5-point action plan 발표
- FDA.Artificialintelligence/machinelearning (AI/ML)-based software as a medical device (SaMD) action plan.
- 21st Century Cures Act에 따라 Clinical decision-support software 등 여러 가이던스 발표함
- 규제하는 산업 분야에서 AI의 안전하고 효과적인 사용이 되도록 감시
- FDA의 4 focus
- 공중 보건을 위한 협력에 도움(fostering collaboration to safeguard public health)
- 조화 표준, 가이드라인, 최적 사용례, 도구의 개발에 도움(promoting development of harmonized standards, guidelines, best practice, and tools)
- 혁신에 도움이되는 고급 규제 전략의 개발(advancing development of regulatory approaches that support innovation)
- AI 성능 평가와 모니터링에 도움이 되는 연구에 도움(supporting research related to evaluation and monitoring of AI performance)
Concepts Pertinent to Regulation of AI by the FDA
AI regulation with the Broader US Govement and Global Context
- PAPNET
- 국제적 기준 확립 및 협력을 위한 FDA의 활동
- IMDRF 의 AI working group 공동 운영(co-lead)
- AI 임상 연구 및 수행을 위한 ICH working group 참여
Keeping Up with the Pace of Change in AI
- AI 활용한 제품의 심사를 위해 유연하고 과학에 기반한 규제 계획(adaptive, science-based regulatory scheme)이 필요함
- 의료기기에 대해서
Flexible Approaches Across the Spectrum of AI Models
- AI 활용 제품의 스펙트럼이 다양함
- 위험도에 기반한 접근이 필요(risk-based approach)
- 위험도가 높을수록 규제 필요성이 더 올라감
- 위험도에 기반한 접근이 필요(risk-based approach)
- 예시: Sepsis ImmunoScore (Prenosis, Inc)
- 의료 제품의 개발에 AI가 활용 잠재성이 높음
- FDA 규제 담당자는 개발된 최종 제품의 이점이 위험도보다 더 높은 지(benefits outweigh its risk for that intended use) 적절히 평가할 수 있어야 함
- 임상 연구 및 시판 후 감시와 평가에도 AI 활용이 가능함
Preparing for the Unknowns of LLMs and Generative AI
- 허가받은 LLM 제품은 아직 없음
- LLM(Large Language Models)이 복잡하고 output도 다양하기 때문에 평가를 위한 특별한 도구가 필요함
- EHR, wearable digital health 기술과 접목되어 활용할 잠재성이 높음
- 규제적 혁신(regulatory innovation)을 통해 임상적 판단 결정(clinical decision-making)에 LLM이 도움이 될 수 있도록 해야 함
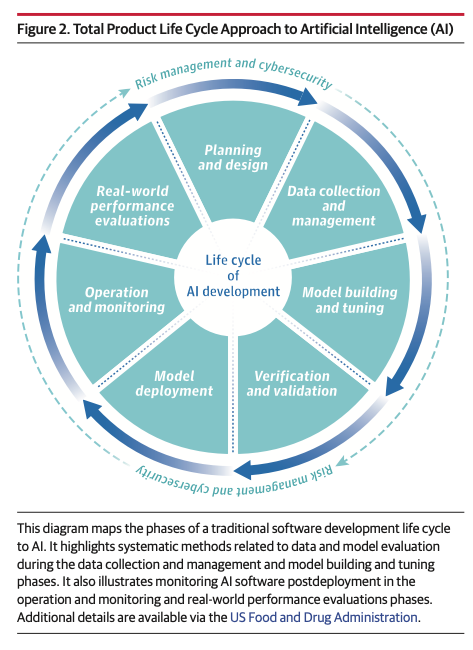
The Central Importance of AI Life Cycle Managment
- AI 성능(AI performance)은 실제로 사용되는 환경에서 평가되어야 함
- FDA의 규제 대상인 산업군은 FDA가 요구하는 법령과 요건들을 반드시 준수해야 함
- by responsible conduct and quality management by sponsors
- AI 적용할 때의 환자의 건강상 유익 health benefit의 평가가 필요함
- 제품 시판 후(after deployment) 성능을 평가하는 과정이 현재 부족함
- AI가 점점 더 많이 활용될 수록 이 부분에 대한 평가, 조사가 더 필요해질 것임
- 제품 시판 후(after deployment) 성능을 평가하는 과정이 현재 부족함
Maintaining Robust Supply Chains
- 제품 공급망(supply chain) 관리에도 AI가 필수적으로 활용될 것임
- 자연재앙, 전쟁 등으로 상황이 바뀔 때에도 빠른 회복이 가능한 시스템 구축을 해야 함
- 이런 AI 기술 적용에 따른 사이버보안 취약점 최소화도 필요
Finding the Balance Between Big Tech, Start-Ups, and Academia
- AI의 상업적 활용을 주도하고 있는 큰 테크 기업과 의료 분야에 기여하려는 많은 작은 start-up 이 개발한 AI model의 안전하고 효과적인 사용이 보장되어야 함
- small business와 학계(academia)를 특별히 돕기(special initiatives) 위한 FDA의 프로그램은 AI에도 적용됨
The Tension Between Using AI to Optimize Financial Returns vs Improving Health Outcomes
- AI 기술을 활용한 제품을 만드는 주체의 ROI(Return on Investment)가 환자에게 더 나은 결과(better patient outcome)와는 상충될 수 있음
- FDA는 국민 보건 발전 및 의과학적 혁신에 대한 강한 목표가 있음(strong mission to both advance public health and biomedical innovation)
- AI 활용이 경제적인 이익(financial retrun on investment)에만 집중되어 개발되지 않도록 해야함
- AI의 임상적 적용이 환자에게 도움이 될 수 있도록 임상의(clinicians)의 역할이 중요함
- 의도적으로, 건강 관련 지표(health outcome)에 집중되도록 하는 것이 예견되는 역작용(health care system의 부담 증가, 환자 효용성 감소, 데이터 독점 등)을 줄이는 데 필요할 것임.
Conclusions
- AI 기술은 빠르게 발전하고 있고 이 적용의 확대에 FDA의 역할이 점점 커질 것임
- 규제 산업군(regulated industries), 학계, FDA 모두 함께 의료 및 의과학(health care and biomedicine) 분야에서 AI 적용의 안전성과 유효성을 평가하고 최적화할 도구를 만들어가야 함
This post is licensed under CC BY 4.0 by the author.