국내 임상통계 관련 진로 소개
학부에서 생물학, 대학원에서 생물통계 석사학위를 받은 후 2010년부터 임상통계 관련 일을 하고 있다.
10여년 동안, 규제기관에 제출되는 임상 자료의 통계 부분을 직접 작성하거나 규제기관(식약처)에서 인허가 승인을 위해 제출된 임상 자료의 통계 부분을 심사하는 일을 해왔고, 여러 임상통계 관련 진로 중에서도 주로 규제기관의 인허가와 관련된 임상통계 진로와 업무에 대해 소개해보려고 한다.
임상통계학은 주로 임상, 의학, 생물과 관련된 데이터의 연구를 위한 통계 방법론을 다루는 응용 통계학(applied statistics)이다. 대학원 임상통계 전공 과정에서 배운 통계 방법론은
- Linear regression
- Linear mixed model
- Survival Analysis
- Categorical Data Analysis
- Multivariate Analysis 등 이고 이런 방법론들은 임상 연구의 결과 분석에 많이 사용된다.
국내에서 임상통계와 관련된 전공은 고려대, 연세대학교 등에 개설된 의학통계학 과정이나 통계대학원에서 생물통계/임상통계 관련 분야를 연구하시는 교수님 밑에서 통계학 전공을 하는 경로가 있다.
임상통계 관련 직업은 관련 전공 석사는 필수로 요구되는 경우가 대부분이고, 통계학 학사로 임상통계 관련 일을 맡는 경우는 드물다
임상통계 관련 진로로는 크게
보건 분야 국가기관
- 질병관리청
- 국립보건원
- 식약처
- 국립 암센터
- 심평원 등
병원
- 큰 병원 내의 임상시험 센터
- 의학통계학 교실 등
사기업
- CRO (임상시험수탁기관)
- 바이오/의료기기/제약회사 등
에 취직하는 경로가 있다.
보건 분야 국가기관에서 하는 임상통계 업무는 각 기관의 성격에 따라 하는 일의 차이가 있다.
국립 보건원이나 국립 암센터처럼 연구를 주로 하는 기관에서는 업무와 관련된 데이터를 수집하고, 수집된 데이터에 대한 통계 분석을 하는 경우도 있고, 식약처 심사부서(의약품/바이오/의료기기)에서 인허가 승인을 받기 위해 업체에서 제출한 임상 관련 자료(임상시험계획서, 임상결과보고서 등)의 통계 기술이 적절한 지를 심사하는 업무도 있다.
같은 기관이라 하더라도 식약처 심사부의 임상통계 심사관으로써 인허가 자료를 심사하는 업무와 심사부가 아닌 식약처 다른 부서의 연구원으로써 국책 과제 등을 맡아 분석 업무를 하는 경우도 있어 세부적으로 하는 업무는 기관과 또 기관 내 부서마다 또 다를 수 있다.
병원의 임상시험 센터, 의과대학과 연계된 의학통계학 교실의 업무는 병원에서 진행되는 의학 연구와 관련된 통계 분석 업무도 있고 의료 정보 관리를 위한 포지션도 있다.
CRO (임상시험수탁기관), 바이오/의료기기/제약회사 등의 사기업에서도 임상통계 포지션이 있다.
CRO는 Contract Research Organization의 약자로, 임상시험 수탁기관이라고도 부른다. 제약회사 등에서 임상시험 관련 업무를 수탁받아서 하는 곳이다. 임상시험 수행부터 분석에 이르기까지 전 과정을 대행한다.
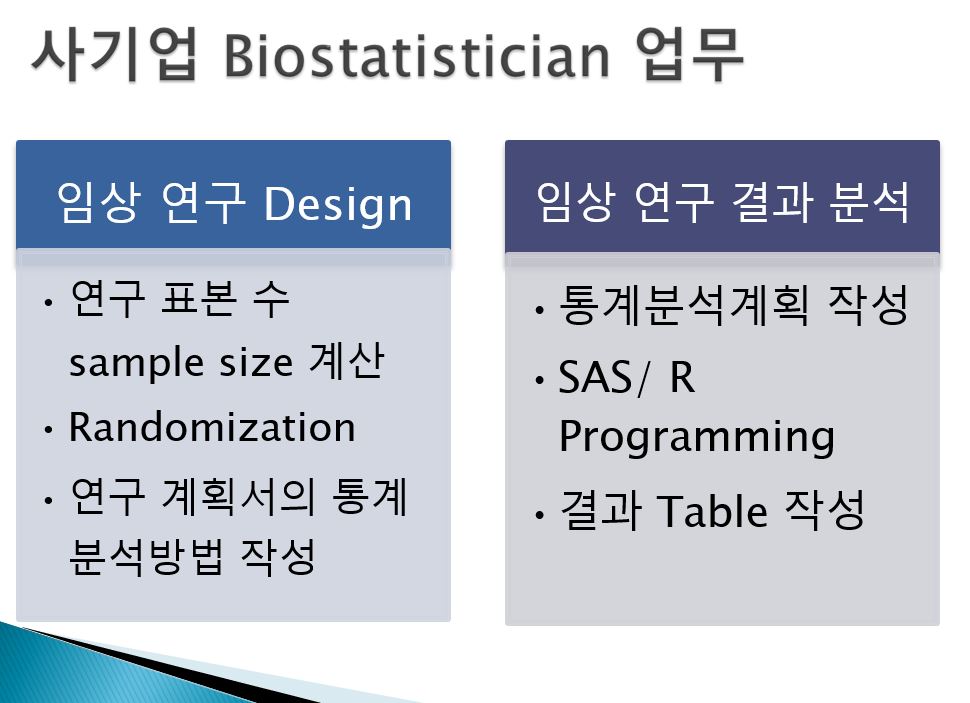
CRO 통계팀에서는
- 임상시험 디자인 (임상시험계획서)
- 피험자 수 (Sample size) 계산
- 무작위배정(Randomization)
- 통계 분석방법 기술
- 임상시험 결과분석 (임상시험결과보고서)
- 통계분석계획서 (SAP) 작성
- SAS/R 을 사용한 통계분석 관련 Programming
- 임상시험 결과 table 작성 등의 일을 한다.
의료기기/바이오/제약회사에서는
회사 제품의 임상시험 업무와 관련된 통계 업무
- 임상시험 디자인
- 임상시험 결과의 통계 분석
- CRO 관리 등
R & D 부서에서 신약 개발 업무 연구와 관련된 임상통계 업무
- 약동/약리학 데이터 수집 및 분석 등 을 한다.
임상과 관련된 대표적 규제기관(Regulatory agency)은 한국의 식품의약품안전처, 미국의 FDA 같은 기관이다.
이런 기관에서는 업체에서 개발한 의료기기, 바이오시밀러, 의약품의 유효성과 안전성에 대한 자료를 심사한 후, 적합할 경우 해당 국가에서 사용, 시판될 수 있도록 인허가를 내주는 일을 한다.
신약이나 예전에 사용된 적이 없는 소재를 사용한 인체 이식 의료기기처럼, 해당 제품의 유효성과 안전성을 입증하기 위해 사람을 대상으로 시험한 임상자료를 반드시 제출해야 하는 경우가 있다.
인허가를 득하기 위해 제품을 개발한 업체에서는 진행할 임상시험의 디자인 및 결과분석 방법에 대한 계획을 자세히 기록한 임상시험계획서와 임상시험을 진행한 후의 임상 시험 결과보고서를 규제기관에 임상자료로 제출한다.
국내의 경우, 기업에서 식약처에 임상계획서를 제출하여 임상계획승인을 받은 후, 임상시험 기관에서 허가용 임상시험을 진행하여 작성된 임상자료를 다시 제출하여 허가를 득하기 위한 임상자료심사가 식약처에서 이루어지게 된다.
식약처 임상통계 심사 담당자는 업체에서 제출한 임상시험계획서나 임상자료에서 안전성과 유효성을 확인할 목적으로 진행된 임상시험의 통계학적 사항들에 대해 심사한다.
구체적으로는 임상시험계획서 상의 시험대상자 수 산출, 임상시험 디자인, 유효성의 평가기준 및 해석 방법에 제시된 통계학적 사항들의 타당성에 대해 검토 및 심사를 한다.
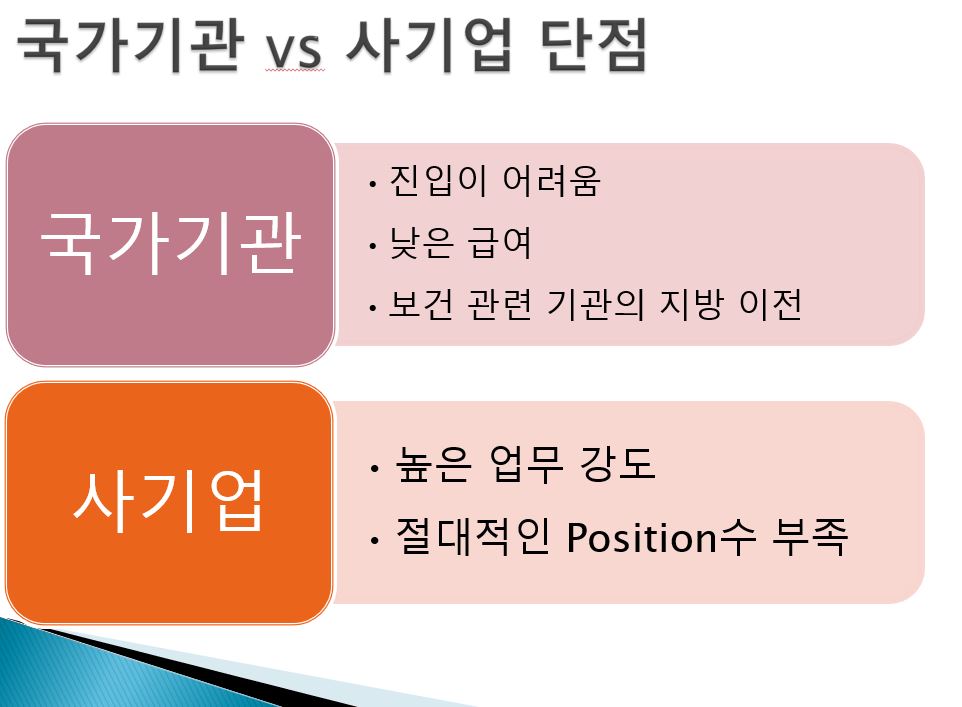
이런 인허가 관련 임상통계 심사 업무는 규제기관(국가기관)에서 일하는 것과 사기업에서 일하는 것 사이의 장,단점이 있는데 내가 생각해본 장점과 단점은 대략 아래와 같다. 
개인적으로 국내 임상통계 현황에 대해 많이 아쉬운 점은 임상통계학자 Biostatistician 으로써 일할만한 절대적인 position의 수가 아직은 너무 적다는 점이다.
그래도 국내의 바이오, 제약, 의료기기 분야의 발전과 함께 규제기관의 인허가 심사와 연관된 임상통계 쪽 일자리도 앞으로는 꾸준히 수요가 증가할 듯 하다.
임상통계학자란 직업은 통계학을 사용하여 의료 제품의 개발과 발전에 관여가 된다는 점에서 멋진 직업이라고 생각하는데 관심 있는 분들에게 이 글이 도움이 되면 좋겠다.